-
Prospective Students
-
Current Students
-
Faculties
-
Maritime Sciences
-
Social Work and Health
- Insight the Faculty
- Contact
- Erstsemesterinformationen
-
Internationales
-
Forschung
- Institute
- Laboratory
-
Projects
- COVID
- EBBiK - Entwicklung von Bildfähigkeit als Bildungsauftrag
- Familienzentrum Aurich (FamZ)
- Kombi-Nord
- Kommunale Suchtprävention in der Satdt Delmenhorst
- Kommunales Teilhabekonzept für die Stadt Emden
- REFU
- Sociotechnical Practices of Objectivation
- SoWeKi
- Suchtpräventionskonzept des Landes Niedersachsen
- Suchtprävention in Schulen (SiS)
- Wer nicht fragt, geht offline: Kids as digital citizens
- Werkstatt für Praxisforschung
- WOGO
- WOGE
-
Team
- Hilfen zum Studium
- Praxisreferat
-
Study Programs Social Work and Health
-
Technology
- Current topics
- Contact
- Study
- Research
-
Projects
-
Cyber-Security-Lab
- Additive Fertigung
- Denkraum
- Designlabor
- FabLab - Labor für studentische Projekte
- Automation Systems
- Bioverfahrenstechnik
- Biochemie/Molekulare Genetik
- Innovationen im Ingenieurwesen
- Instrumentelle Analytik
- Labor Intelligente Produktionssysteme
- Kolbenmaschinen
- Machine dynamics
- Leichtbaulabor
- Maschinenelemente
- Mechatronik
- Mikrobiologie
- Organische Chemie/Nachwachsende Rohstoffe
- Physikalische Chemie
- Polymere
- Lab for production planning
- Produktionstechnik
- Networked Systems
- Regelungstechnik
- Labor S4
- Technische Informatik
- Verfahrenstechnik
- Werkstoffkunde, Laser- und Fügetechnik
- wind energy lab
- Zellkulturtechnik
- IT-Sec-Lab
- Research / Institutes
- Insight the Faculty
-
Study Programs
- Applied Life Sciences (Master)
- Biotechnology
- Biotechnologie im Praxisverbund
- Business Intelligence and Data Analytics
- Chemical Engineering/Environmental Technology
- Chemietechnik im Praxisverbund
- Electrical Engineering
- Electrical Engineering (Dual Study)
- Engineering Physics
- Engineering Physics (Master)
- Renewable Energy and Energy Efficiency
- Industrial Informatics (Master)
- Computer Science
- Computer Science (Dual Study)
- Mechanical Engineering and Industrial Design
- Mechanical Engineering and Industrial Design (dual degree course)
- Mechanical Engineering (Master)
- Medieninformatik (Online)
- Medieninformatik (Online, Master)
- Media Technology
- New study program page NaPriMa
- Nachhaltige Prozesstechnologie
- Nachhaltige Prozesstechnologie (PV)
- Wirtschaftsinformatik (Online)
- Regenerative Energien (Online)
- Technical Management
- Technology of Circular Economy
- Computer Science and Economics
- Wirtschaftsingenieurwesen – Engineering & Management
-
Business Studies
- Module manuals, regulations & preliminary work
- News, dates & information about the current semester
- Projects & Research
-
Courses of studies
- Business Management (M. A.)
- Energy & Sustainability Management (B. Sc.)
- Digital Management (B. Sc.)
- Business Management - BWL (B. A.)
- International Business & Culture (B. A.)
- Betriebswirtschaft dual (B.A.)
- Business Studies (B. A.)
- business psychology
- International Business Administration (B.A. )
- Advanced Management berufsbegleitend (M. Sc.)
- Advanced Management Stipendium
- Management Consulting (M.A.)
- Business Informatics (Online)
- Team
- Before your studies
- Graduates & Alumni
-
Auslandsbüro
- In studies
- Information for schools
-
Maritime Sciences
- Studium
- Services
- International campus
-
Life on campus
-
Faculties
-
QuickLinks
-
University of Applied Sciences
- Für Unternehmen
-
Centre for further education
- Übersicht
-
Weiterbildungen
- Burnout-Prophylaxe
- Cybercrime
- Gamification für Businesstransformation
- Business Basics for School
- Sustain 2030
- Lean Management
- „Nordbeat–der Norden macht Zukunft:Tag der Weiterbildung
- Business 2 Business - 5.0
- Betrieblicher Gesundheitsmanager in BPS
- Programmieren mit Scratch
- Cyber-Security Hacking Training
- Konfiguration mit Sidekick -Humanisierung der KI
- Kommunikation, Wertschätzung und Selbstmanagement
- Konflikt-Kommunikation
- Kommunikation und Gesprächsführung:Konflikt-Kommunikation
- Kommunikation & Zusammenarbeit
- Humor in der Beratung
- Kundenzentrierung-Customer Centricity für KMU & Start-UP
- Nachhaltigkeitsberichterstattung
- Gewaltfreie Kommunikation
- Casemanagement im Praxisalltag
- Trauma-Pädagogik
- Reflexionstag
- Outdoor-Erlebnis
- Finance for non-finance
- Management-Essentials: Gamification für BWL-Einsteigende
- Marketing Praxiswerkstatt
- Software Development
- Nachhaltige Führungskräfteentwicklung
- Agile Frameworks I
- Einführung in die Produktionstechnologie
- Traumaberatung
- Systemische Beratung und Coaching
- Windenergie-Nutzung
- The region in focus
- press
-
Organization
-
Departments A-Z
- Workplace Safety
-
University Library
-
CampusDidaktik
- Team CampusDidaktik
- Tag der Lehre
- Q&A
- Positionspapiere
- Tools für Lehre und Zusammenarbeit
- Moodle
- Impulse und Inspiration für die Lehre
- Moodle
- Kleingruppenarbeit begleiten
- Urheberrecht in der Lehre
- KI in der Hochschullehre
- Hybride Lehre
- Barrierefreiheit in der Lehre
- Planspielzentrum
- Digitale Prüfungen
- Institut für projektorientierte Lehre (Ipro-L)
- Didaktische Beratung
- Career Service
- Datenschutz
- Finanzabteilung
- Gebäudemanagement
-
Gleichstellungsstelle
- Organizational Development and Quality Management
- health & sports
-
Admission and Examination Office
-
International Office
- Your way abroad
-
International Students
- German Classes
- FAQ incoming students
- degree-seeking students
- Exchange Students / ERASMUS+
- Housing
- Buddy-Program for International Students
- International Sustainability Program
- Living Expenses
- Scholarships
- Visa
- Health Insurance and Co.
- Studying with Impairment (Inclusion and Accessibility)
- Internships & Jobmarket
- Event notes
- Internationalization at home university
- Partner Universities
- Staff Mobility
- Contact & Download Area
- Allgemeines über das ERASMUS+ Programm
- Kommunikation und Hochschulkultur
- MeerCommunity Startup Center
-
Sustainability
- Ombudswesen
-
Personalabteilung
- Staff Council
- Präsidialbüro/Presse- und Öffentlichkeitsarbeit
- Computer Center
- Language Centre
- Studium Generale
- MyCampus
- [Translate to english:] Operating group ver.di
-
Wissens- und Technologietransfer
-
Student Counselling Service
- Zentrum für Weiterbildung
- Karriere
- Administration
- Events
- Mission statement
- Organizational chart
- Figures, data and facts
-
Regulations, guidelines and announcements
- Regulations and rules
-
Ordnungen für Studiengänge
- Advanced Management
- Applied Life Sciences
- Betriebswirtschaft
- Betriebswirtschaft (dual)
- Biotechnologie/Bioinformatik
- Biotechnologie
- Biotechnologie im Praxisverbund
- Business Administration (dual)
- Business Intelligence and Data Analytics
- Business Management
- Business Management (Bachelor)
- Chemietechnik/Umwelttechnik
- Chemietechnik im Praxisverbund
- Digital Management
- Elektrotechnik
- Elektrotechnik im Praxisverbund
- Elektrotechnik und Automatisierungstechnik
- Energieeffizienz
- Energy and Sustainability Management
- Engineering Physics (Bachelor)
- Engineering Physics im Praxisverbund
- Engineering Physics (Master)
- Erneuerbare Energien und Energieeffizienz
- Industrial Informatics
- Informatik
- Informatik im Praxisverbund
- Inklusive Frühpädagogik
- Interdisziplinäre Physiotherapie/Motologie/Ergotherapie
- International Business Administration
- Internationaler Studiengang Wirtschaftsingenieurwesen (IBS)
- International Business and Culture
- Kindheitspädagogik
- Lasertechnik
- Management Consulting
- Maritime Operations
- Maritime Technology and Shipping Management
- Maschinenbau
- Maschinenbau und Design
- Maschinenbau und Design für Berufsqualifizierte
- Maschinenbau und Design im Praxisverbund
- Medientechnik
- Nachhaltige Produktentwicklung im Maschinenbau
- Nachhaltige Prozesstechnologie
- Nachhaltige Prozesstechnologie im Praxisverbund
- Nautik
- Nautik und Seeverkehr
- Online-Bachelorstudiengang Medieninformatik (Voll-/Teilzeit)
- Online-Masterstudiengang Medieninformatik (Voll-/Teilzeit)
- Online-Bachelorstudiengang Regenerative Energien
- Online-Bachelorstudiengang Wirtschaftsinformatik (Voll-/Teilzeit)
- Online-Masterstudiengang Wirtschaftsinformatik
- Physiotherapie
- Schiffs- und Reedereimanagement
- Soziale Arbeit
- Soziale Arbeit (BASA-online)
- Soziale Arbeit und Gesundheit im Kontext sozialer Kohäsion (Vollzeit/Teilzeit)
- Soziale Kohäsion im Kontext Sozialer Arbeit u. Gesundheit
- Sozial- und Gesundheitsmanagement
- Sozialmanagement
- Sustainable Energy Systems
- Technical Management
- Technology of Circular Economy
- Wirtschaftsinformatik (Dual)
- Wirtschaftsingenieurwesen Maritime Wissenschaften (B.Sc.)
- Wirtschaftsingenieurwesen - Engineering & Management
- Wirtschaftspsychologie
- Verkündungsblätter
- Committees
- University representatives
- University elections
-
Departments A-Z
- Study locations
-
Research
-
Focuses
- Research strategy
- Forschungsschwerpunkte
-
Forschende
- Seefahrt und Maritime Wissenschaften
- Soziale Arbeit und Gesundheit
-
Wirtschaft
- Prof. Dr. Knut Henkel
- Prof. Dr. Tom Koch
- Prof Dr. Ute Gündling
- Prof Dr. Annika Wolf
- Prof. Dr. Jan Handzlik
- Prof. Dr. Hans-Gert Vogel
- Prof. Dr. Till Becker
- Prof. Dr. Henning Hummels
- Prof. Dr. Thomas Lenz
- Prof. Dr. Wolfgang Portisch
- Prof. Dr. Jan Christopher Pries
- Prof. Dr. Ute Rademacher
- Prof. Dr. Marco Rimkus
- Prof. Dr. Eva-Maria Schön
- Prof. Dr. Joachim Schwarz
- Technik - Elektrotechnik + Informatik
- Technik - Maschinenbau
-
Technik - Naturwissenschaftliche Technik
- Prof. Dr. Gerhard Illing
- Prof. Dr. Gottfried Walker
- Prof. Dr. Ingo de Vries
- Prof. Dr. Mark Rüsch gen. Klaas
- Prof. Dr. Jens Hüppmeier
- Prof. Dr. Iván Herráez
- Prof. Dr. Ralf Habermann
- Dr. Julia Jessica Reimer
- Prof. Dr. Claudia Gallert
- Prof. Dr.-Ing. Philipp Huke
- Prof. Dr. Martin Silies
- Prof. Dr. Martin Sohn
- Prof. Dr. Sven Steinigeweg
- Prof. Dr. habil. Ulrich Teubner
- Folgeabschätzung und Ethik
-
Projects
-
Aktuelle Forschungsprojekte
- OS-LOTSE
- InnoWerft PLUS
- ASTRA
- Adaptive Fortbildungen in der medienpädagogischen Altenbi
- AnkerPROF
- BUFFER+
- EARLY
- Entwicklung eines Reinigungsroboters für Offshore-WKA
- ExStyrol
- FlettnerFLEET
- GE-VORS
- Hyper4Rail
- INDUZELL
- InnoWerft
- Integrierte und innovative maritime Technologien für Mobi
- ISE-FiT Nordwerst
- KUNO
- MIINTER
- MeerCommunity
- NESSIE
- Nordwest Niedersachsen Nachhaltig Neu (4N)
- PANTHER
- ProlOg
- ReqET
- SIoT-Gateway
- SoGeWi
- SoWeKi
- StaKiNd
- Standardisierung, Weiterentwicklung und Kommunikation von
- Transferzentrum für Nachhaltige Mobilität
- TwinMaP
- VOLAP
- Wind & Regio
- W4S - Wind4Shipping
- WaddenVision
- Projekte nach Bereichen
- Beendete Projekte
-
Aktuelle Forschungsprojekte
-
Research institutes
- Promotionskollegien
-
Institute
-
Netzwerke
- Nationalpark Wattenmeer
- Promotionsnetzwerk Emden/Leer
- Digital Hub Ostfriesland (DHO)
- Tötungshandlungen in Einrichtungen des Gesundheitswesens
- Wachstumsregion Emsachse
- Maritimes Kompetenzzentrum (Mariko)
- greentech Ostfriesland
- NorShiP-Research School
- Association of Schools of Public Health
- Hochschulen für Gesundheit
- Deutsche Gesellschaft für Public Health
- Powerhouse Nord
- GENDERnet
- Einrichtungen in den Fachbereichen
-
Advice
-
Focuses
You are here:
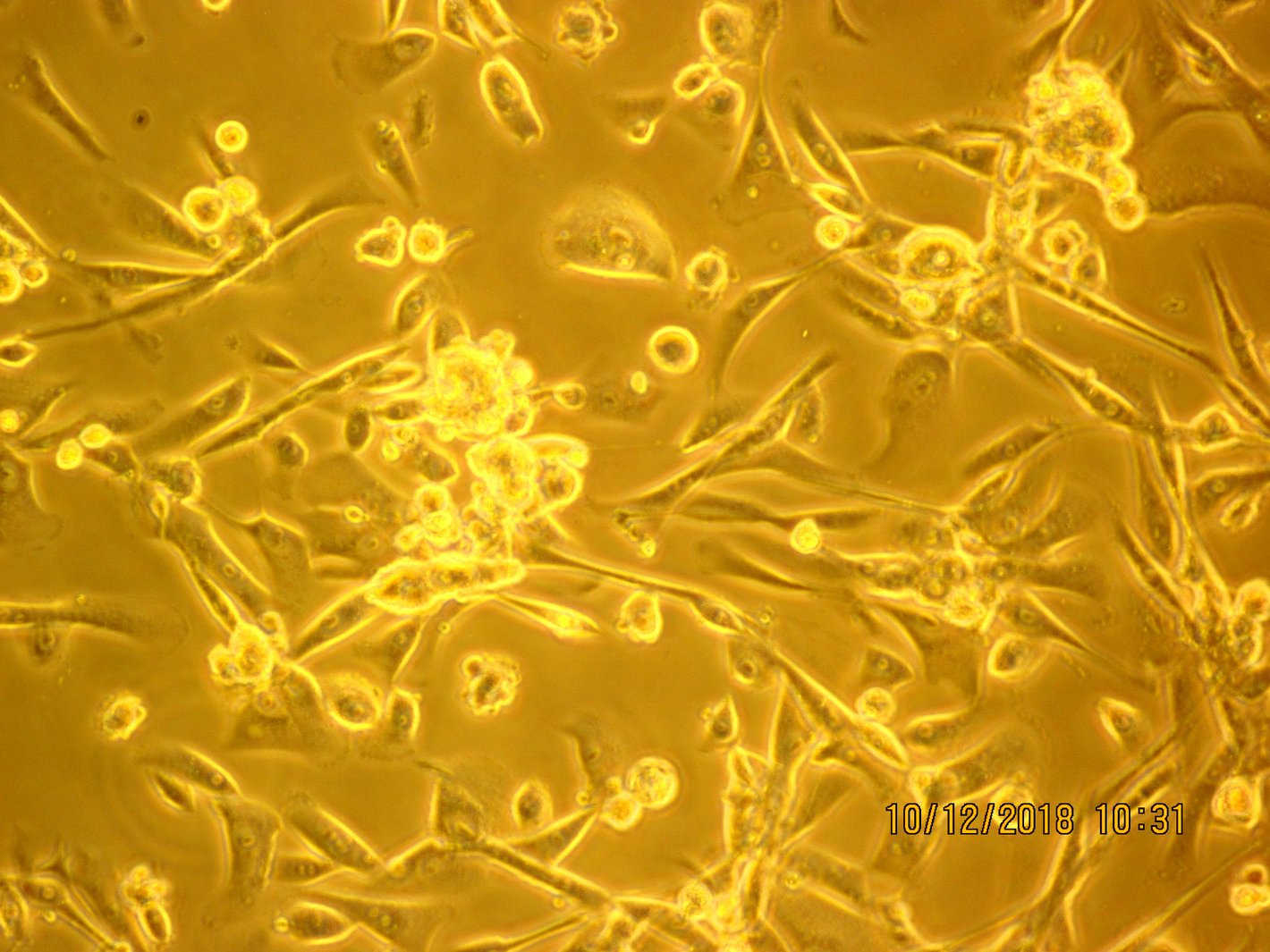
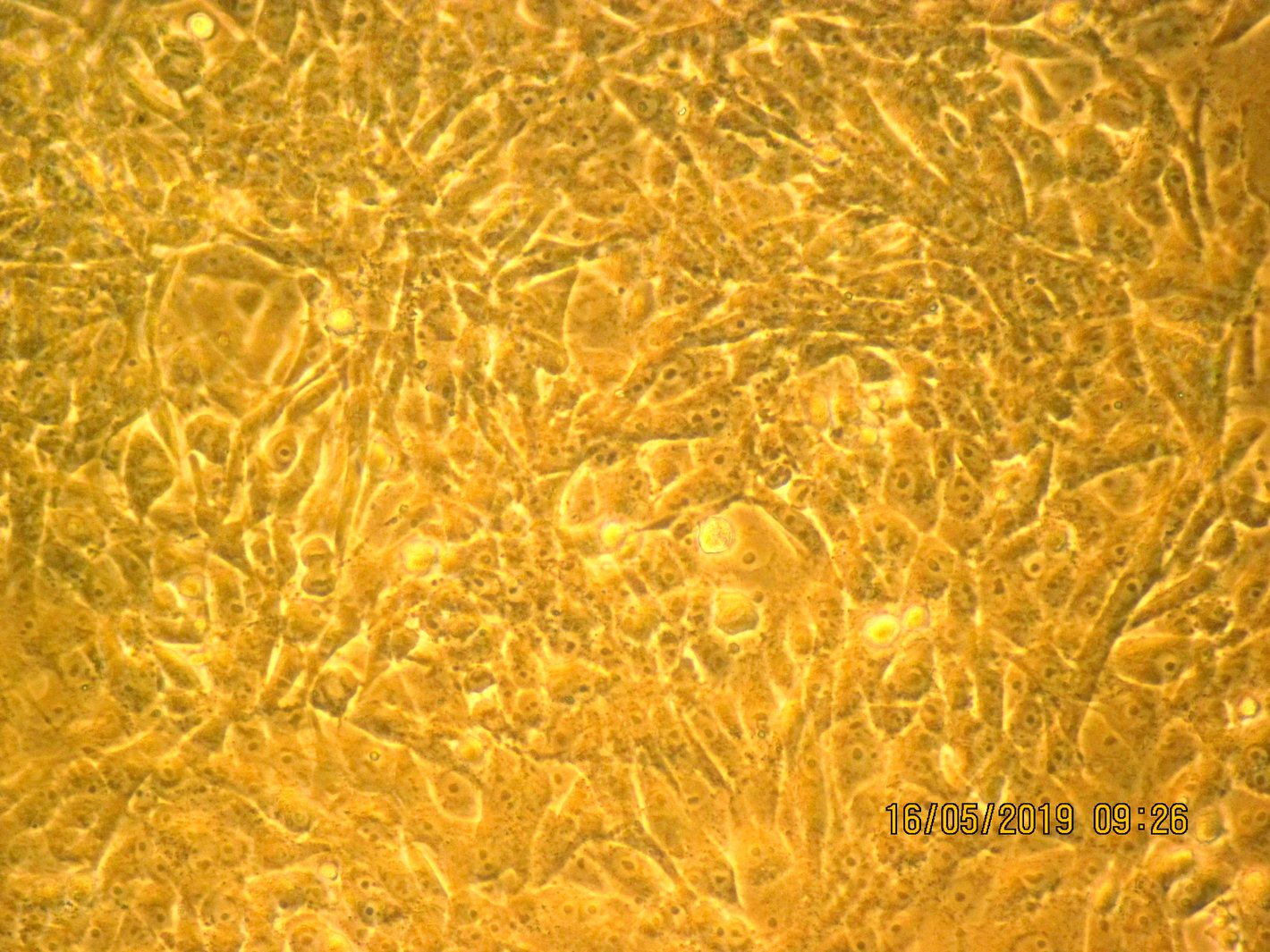
Labor Zellkulturtechnik
Im Labor T9.2 werden Forschungsarbeiten und Praktika aus dem Bachelor-Studiengang „Biotechnologie“ sowie dem Master-Studiengang „Technology of Circular Economy“ durchgeführt.
Das Labor beinhaltet die Infrastruktur für die Kultivierung von Zellkulturen in verschiedenen Kulturmaßstäben und die Entwicklung und Herstellung von notwendigen Zellkulturmedien. Zur Ausstattung gehören Bioreaktoren und andere Kultivierungsgefäße, Inkubatoren, Sterilwerkbänke (Clean benches), Kryolagerung sowie Geräte zur Analytik wie Zellzählung, Glucose-/Laktatbestimmung, Fluoreszenzmikroskopie.
Leitung:
Prof. Dr. Ingo de Vries
Tel. 04921-807-1572
Raum T1115
Mitarbeiterinnen:
Sybille Janssen-Weets
Tel. 04921-807-1575
Raum T9.6
Der Fokus der Arbeiten liegt auf der Kultivierung und Adaption von Zellkulturen
im Rahmen der Prozessoptimierung sowie auf der Weiterentwicklung der
Zellkulturmedien durch die Optimierung ihrer Zusammensetzung. Die Praktika
dauern in der Regel zwei Wochen, während Projekte eine längere Dauer in Anspruch
nehmen können. Beide erfordern regelmäßige, häufig tägliche Kontrollen der
Zellkulturen, bei denen wesentliche Parameter analysiert werden.
Beispiele für Praktikumsversuche:
- Zellen in adhärenter Kultur: Die Kultivierung erfolgt in T25-Flaschen. Tägliche Fotodokumentationen und Ernten zu ausgewählten Zeitpunkten werden durchgeführt, um den Konfluenzgrad zu analysieren, eine Wachstumskurve zu bestimmen, Zellzahlen zu ermitteln und die Zellvitalität zu überprüfen.
- Suspensionskultur: Die Kultivierung erfolgt in einem definierten, proteinfreien Medium. In den Versuchen werden verschiedene Kulturparameter variiert und ihre Auswirkungen untersucht, wie z.B. Art und Geschwindigkeit der Rührung, der Vergleich von Shaker- und Spinnergefäßen, der Einfluss von Additiven sowie die Variation der Zellkulturmedien-Formulierungen. Zu den regelmäßigen Analysen gehören die Bestimmung von Glukose-, Laktat- und Gesamtzellkonzentration sowie die Erhebung von Wachstumskurven als wichtiges Werkzeug in der Prozessentwicklung.
- Zytotoxizitätstest: Als tierversuchsfreie Methode wird die Reaktion von Zellkulturen auf Testsubstanzen untersucht. Die Kulturen werden in Multiwellplatten angesetzt, und die Analytik erfolgt durch die Messung der vitalitätsabhängigen Veränderung biochemischer Aktivität im Kurztest mittels Fluoreszenzmessung (Alamar blue-Test) oder photometrischer Messung (MTT-Test). Die Bestimmung der Wirkstärke erfolgt durch Ermittlung der EC50- oder ED50-Werte.
Blick ins Labor